Batterie de voiture : comment ça fonctionne ?

Nous allons voir ici le principe de fonctionnement d'une batterie de voiture, c'est à dire d'une batterie au plomb.

Principe de base
Comme toute batterie, et quelque soit sa technologie, il s'agit de récupérer l'électricité produite par une réaction chimique. L'avantage d'une batterie (contrairement à une pile) est que la réaction chimique est réversible. En effet, une fois que la réaction a eu lieu, la batterie est à plat et il n'y a plus rien à en attendre ... Cependant, tout peut être remis à zéro en réinsérant de l'électricité (grosso modo) à l'intérieur (la réaction chimique se fait alors à l'envers, remettant tout à zéro !).
Constituants de la batterie
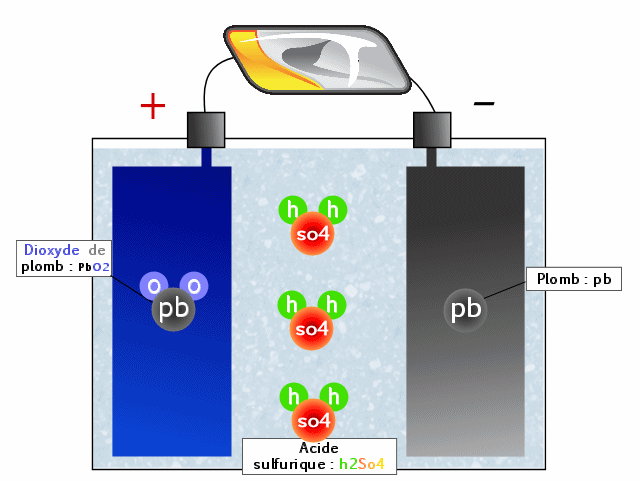
On distingue dans les batteries trois grands éléments :
- L'électrolyte qui est composé d'acide sulfurique. C'est dans cette solution liquide que baignent les électrodes
- Electrode (borne +) dite cathode qui a tendance à vouloir prendre/attirer des électrons (les grains d'électricité qui servent aussi de coquille aux atomes, les grains de la matière qui forment tout), elle les attire naturellement car elle en maque un peu pour être stable. Car chaque atome a un noyau positif (+) et des électrons qui tournent autour négatifs (-). Quand le positif et le négatif ne sont pas égaux, il y a un déséquilibre qui va être soit négatif soit positif, d'où le fait que certains matériaux attirent les électrons et d'autres les rejettent. Sur la batterie d'une voiture, la cathode sera une "barre" de dioxyde de plomb (c'est à dire du plomb couplé à du dioxygène : deux atomes d'oxygène ensembles)
- Electrode (borne -) dite anode qui a tendance à donner des électrons. Il s'agit simplement de plomb.
Notez que les anodes et cathodes ne doivent pas être en contact direct, car il y aurait un court circuit. Il en résulte une vraie petite usine chimique qui va pouvoir générer de l'électricité quand il y a une réaction chimique entre l'anode, la cathode et l'électrolyte. Mais pour la déclencher, il faut mettre en contact l'anode et la cathode, c'est à dire faire fonctionner des organes électriques.
Réaction chimique : la décharge
.gif)
En mettant en contact les deux bornes (on utilise donc la batterie), les électrons (l'électricité donc) de l'anode (-) vont vouloir aller vers la cathode (+) du fait de la propriété des matériaux expliquée plus haut. Hélas, quand des électrons partent d'une électrode à l'autre, cela provoque un déséquilibre chimique (des "morceaux de coquilles" des atomes, les électrons, manquent à l'appel !). Et il va falloir que tout cela s'équilibre d'une manière au d'une autre ...
.gif)
Résultat, le tout va retrouver l'équilibre (je ne vais pas entrer dans les détails de la mutation) par une réaction chimique :
- La cathode (+) qui était du dioxyde de plomb va devenir du sulfate de plomb
- L'anode (-) qui était en plomb va aussi devenir du sulfate de plomb
- Le bain dans lequel baigne tout ça (l'électrolyte) se transforme en grande partie en eau (H2O) mais une petite partie reste à l'état d'acide sulfurique
Quand les deux électrodes se sont transformées en sulfate de plomb, il n'y a plus de différentiel entre ces dernières. A la base, la cathode attirait les électrons et l'anode en donnait grâce aux propriétés des matériaux qui les composaient, mais maintenant on a affaire à deux matériaux similaires ... Et puis l'électrolyte est désormais constituée d'eau majoritairement.
Réaction chimique à la recharge : électrolyse*
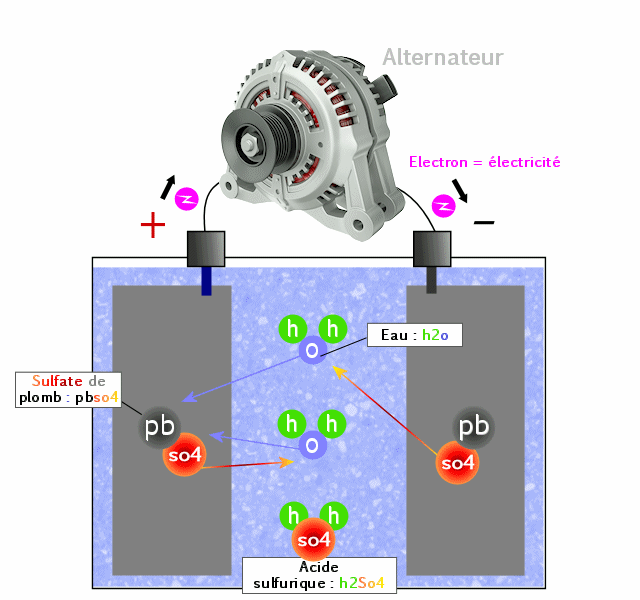
Pour la recharge, tout va se passer dans l'autre sens. On va donc injecter des électrons dans l'anode et en reprendre à la cathode, ce qui aura pour effet de forcer la réaction inverse. Une fois fait, on peut repartir dans l'autre sens, c'est à dire utiliser la batterie.
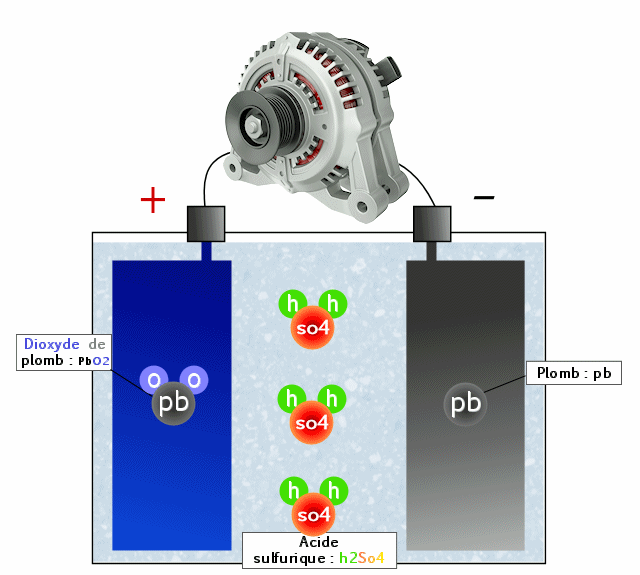
Cellules / accumulateurs ?
Pour former une batterie de 12 v, il y a en vérité 6 cellules de 2 volts environ, ce qui fournit alors 12v car 6 X 2 = 12.
Pourquoi au plomb ?
Pourquoi utilise-t-on encore des batteries au plomb, qui paraissent archaïques par rapport à du lithium ? Et bien la batterie au plomb permet bien plus de cycles de recharge/décharge et elle fournit en plus une plus grosse intensités au niveau du courant (important pour faire fonctionner un démarreur, qui doit lutter pour entrainer le moteur doté d'une forte compression). Hélas, leur défaut est d'être plus encombrante ...
Durée de vie ?
Tant qu'elle ne subira pas de décharge dite "profonde" (quand elle est à plat), cette dernière pourra subir des milliers de cycles et une dizaine d'années. Cependant, au bout d'une vingtaine de décharges profondes/totales, elle rendra généralement l'âme.
Caractéristiques d'une batterie
Volt
C'est la tension électrique. Moins facile à appréhender que l'ampère, il s'agit en gros de la "grandeur d'électricité qui peut être générée".
A : ampère(s)
L'ampérage permet de connaitre l'intensité du courant qui passe dans un câble. Plus il y a d'intensité (et donc d'ampères) plus il y a d'électrons qui passent. Plus il y en a, et plus le métal va rougir car cela va provoquer de la chaleur : c'est le frottement des électrons, très nombreux, qui se compriment les uns aux autres, cela peut se comparer à la pression dans un tuyau d'arrosage, plus vous mettez fort, plus il y a de pression.
La donnée inscrite sur une batterie de voiture indique le nombre d'ampères qu'elle peut libérer pendant 30 secondes dans des conditions de température de -18°. Plus ce chiffre sera important, plus la force délivrée pendant ces 30 secondes sera importante. Donc si votre voiture a tendance à avoir du mal à démarrer, essayez de prendre du gros calibre en ce qui concerne cette donnée.
Ah : ampère(s) par heure
C'est la capacité qu'elle peut avoir en son "ventre". Plus le chiffre sera gros, plus vous aurez des "réserves d'électricité". Une batterie de 800 ah pourra délivrer 800 ampères sur une heure ... Mais aussi 400 ampères pendant 2 heures, ou même 200 pendant 4 heures.
Ces articles pourraient vous intéresser :
- Pourquoi le Sans Plomb 98 coûte plus cher que le sans plomb 95 ?
- Batteries solides et semi-solides : différences
Ecrire un commentaire
Sondage au hasard :
Trouvez-vous les montants des PV bien adaptés aux infractions commises ?
© CopyRights Fiches-auto.fr 2025. Tous droits de reproductions réservés.
Nous contacter - Mentions légales
Fiches-auto.fr participe et est conforme à l'ensemble des Spécifications et Politiques du Transparency & Consent Framework de l'IAB Europe. Il utilise la Consent Management Platform n°92.
Vous pouvez modifier vos choix à tout moment en cliquant ici.



