Les différents types et chimies de batteries lithium-ion (voitures électriques)
- Synthèse des avantages et inconvénients des différents types de batteries lithium
- Différence lithium-ion, Li-ion, Li+ et lithium métal
- Batterie Silicium ?
- Batterie au Dioxyde de Cobalt de Lithium LiCoO2 (LCO/LICO)
- Batterie Lithium Fer Phosphate LifePo4 (LFP + LmFP + LFPx)
- Batterie Lithium Nickel Cobalt Manganèse LiNiMnCoO2 (NMC)
- Batterie Lithium oxyde d'Aluminium Nickel Cobalt LiNiCoAlO2 (NCA)
- Batterie Lithium Manganèse LiMn2O4 (MVO)
- Avant la technologie lithium : Batterie au Plomb
- Batterie Titanate de Lithium Li4Ti2O12 (LTO)
- Batterie polymère LMP Lithium Métal Polymère ?
- Graphène ?
- Supercondensateur et graphène ?
- Silicium ?
- Batteries du futur ?

Quels sont les différents types de batteries lithium qui existent dans les voitures électriques et quels sont leurs avantages et inconvénients. Avec la démocratisation de la propulsion électrique il y a une émulsion importante du côté de la recherche de ce type d'accumulateurs. Voyons donc un peu où nous en sommes en listant les différentes catégories de batteries.
.jpg)
Sachez toutefois que si les formules changent (côté cathode principalement), le principe de fonctionnement reste le même pour toutes les batteries au lithium-ion. La diversité des chimies ne va jouer que sur les caractéristiques de la batterie et non pas son principe de fonctionnement.
A lire aussi : les différents types de cellules de batterie lithium
Synthèse des avantages et inconvénients des différents types de batteries lithium
Retrouvez plus bas de plus amples détails sur les différents types de chimies.
| Type Batterie (Chimie) |
Densité énergétique (kWh/kg) |
Densité de puissance (kW/kg) |
Sécurité | Tolérance aux fortes températures |
Durée de vie | Coût |
|---|---|---|---|---|---|---|
| LiCoO2 | 7/10 | 4/10 | 4/10 | 6/10 | 4/10 | 6/10 |
| NMC | 7/10 | 6/10 | 6/10 | 6/10 | 6/10 | 6/10 |
| LFP | 5/10 | 8/10 | 8/10 | 8/10 | 8/10 | 8/10 |
| NCA | 8/10 | 6/10 | 4/10 | 6/10 | 6/10 | 4/10 |
| LMO | 5/10 | 6/10 | 6/10 | 4/10 | 4/10 | 6/10 |
| LTO | 3/10 | 6/10 | 8/10 | 8/10 | 8/10 | 2/10 |
| SOLIDE | 10/10 | 10/10 | 10/10 | 10/10 | 1/10 |
A lire aussi :
- Détails sur la densité énergétique des différentes chimies
- Avantages des batterie solides
- Fonctionnement détaillé des batteries lithium-ion
Différence lithium-ion, Li-ion, Li+ et lithium métal

Entre Lithium, Lithium-ion et Li-ion il y a de quoi perdre ses repères ...
Pour être précis, Lithium-ion et Li-ion sont identiques, et il faut donc distinguer les batteries Lithium-ion (= Li-ion = Li+) des batteries lithium métal. Sur les batteries Lithium-ion (les plus courantes), le lithium n'est présent que dans les ions qui se déplacent du - au + (décharge) ou du + au - (recharge) par l'électrolyte. Donc on en trouve agglutiné sur les anode et cathode mais aussi dans l'électrolyte quand ils vagabondent d'une électrode à l'autre. L'anode (-) est ici généralement en graphite.

C'est le type de batterie qui représente la très grande majorité du marché
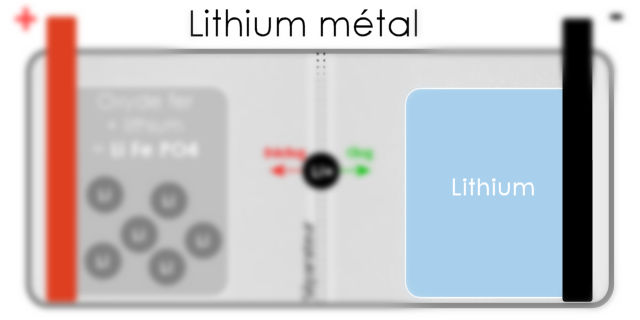
Une batterie lithium métal va plus loin en ayant cette fois une anode (-) composée de métal lithium (pas sous forme d'ions ici puisqu'ils sont neutres : 3 protons + pour le noyau et 3 électrons - pour la couche électronique). Toutefois, il y a quand même des ions lithium qui se baladent en plus entre les électrodes.
Pour faire simple, les lithium-ion se contentent d'avoir du lithium ionisé (Li+) qui va du + au - (et inversement) alors qu'une lithium métal ajoute en plus une anode (électrode négative) faite de matière lithium au lieu du graphite habituellement présent à cet emplacement.
Batterie Silicium ?

Batterie au Dioxyde de Cobalt de Lithium LiCoO2 (LCO/LICO)
C'est la mère des batteries lithium, la première technologie à avoir été commercialisée.

C'est un des nombreux dérivés de la batterie Lithium-ion, mais en même temps c'est la plus ancienne et la plus traditionnelle si on peut dire. On exploite donc, comme toujours, les atomes de Lithium ionisés avec une anode (-) en graphite (carbone mis en couches superposées). Ce type d'accumulateur a des défauts notoires, à savoir une durée de vie courte et une vitesse de charge relativement lente. Mais parmi les avantages on note un coût de revient relativement faible et une densité énergétique très respectable. Cette technologie convient plus aux téléphones (entre autres) qu'aux automobiles, et c'est finalement la seule sur cette page qu'on aurait pu se passer de décrire.
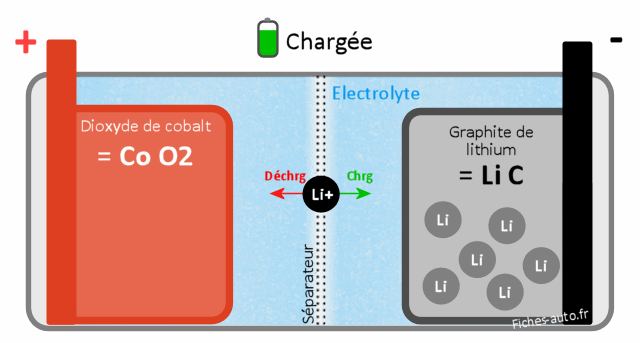
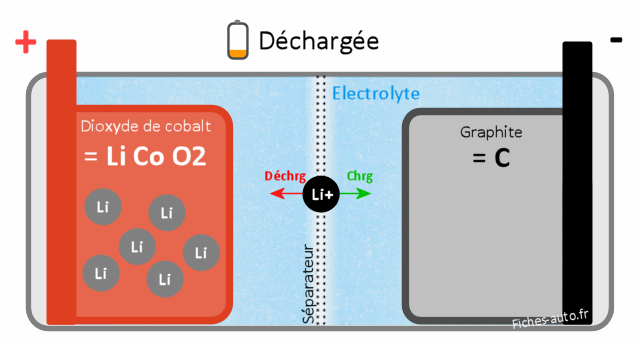
Batterie chargée : du côté cathode on a CoO2 (dioxyde de cobalt) et côté anode du LiC (graphite de Lithium)
Batterie déchargée : du côté cathode on a du LiCoO2 (dioxyde de cobalt de Lithium) et côté anode du C (carbone / graphite)
Le cycle de vie est aux alentours de 800 cycles charge/décharge.
La tension d'une cellule est d'environ 3.6 Volts
La densité énergétique se situe aux alentours de 200 Wh par kg
Batterie Lithium Fer Phosphate LifePo4 (LFP + LmFP + LFPx)
C'est la technologie qui permet avant tout de limiter le coût de revient.

C'est une technologie au Lithium qui sert aussi pour les batteries de servitude 12V. Elle remplace donc de plus en plus les batteries au plomb et sert à alimenter les accessoires électriques de l'auto.
Mais cela n'empêche pas de l'utiliser comme batterie de traction, avec notamment les Tesla SR+.
Côté inconvénients c'est un type de batterie qui a une densité énergétique moins importante d'environ 15% (elle est donc plus lourde que les autres chimies, et donc aussi plus encombrante si on veut avoir un équivalent en terme de capacité). Sa masse accrue (densité moindre) induit aussi qu'il faille plus de temps pour qu'elle chauffe, ce qui la rend un peu moins efficiente à froid (ou plutôt elle mettra un peu plus de temps à être à température). Enfin, sa courbe de décharge assez plate accentue la difficulté pour le BMS d'estimer la réserve d'électricité restante (kWh/% de la batterie).
Côté avantages on peut la charger à 100% sans que ça ne la dégrade trop (ça l'use plus vite mais de manière moins intense qu'avec les autres chimies). Il faut même régulièrement la charger à 100%, car les LFP ont tendance à avoir des cellules qui se déséquilibrent plus facilement en raison d'une auto-décharge aléatoire de ces dernières, ce qui mène à une multitude d'unités qui n'offrent plus le même voltage. Pour résoudre cela, la charge à 100% permet au BMS de tout remettre à plat avec à la clé un réquilibrage du voltage de l'ensemble des cellules.
Elle est aussi plus résistante à la chaleur, ce qui permet de pouvoir la solliciter plus en conduite sportive (hélas c'est aussi la même chose dans le sens inverse, quand elle est chaude il faut plus de temps pour la refroidir).
Cerise sur le gâteau, son coût est inférieur aux autres technologies car on évite les très chers cobalt et nickel. On profite aussi d'une belle sécurité puisque sa stabilité thermique est supérieure.
On relèvera aussi sa très bonne longévité par rapport aux autres technologies, avec un nombre de cycles qui permet une belle pérennité dans le temps.
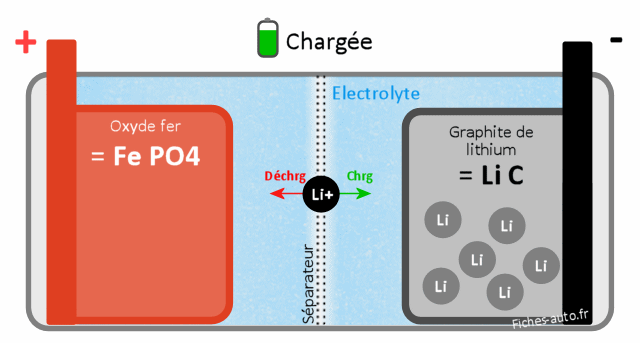
Batterie chargée : du côté cathode (+) on a du FePO4 (phosphate de fer) et côté anode du LiC (graphite de Lithium)
Batterie déchargée : du côté cathode on a du LiFePO4 (Lithium Fer Phosphate) et côté anode (-) on a du C (carbone / graphite, à savoir des couches de carbones bien organisée au niveau moléculaire)
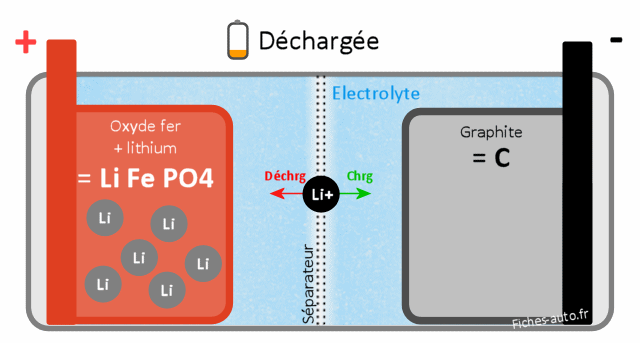
Le cycle de vie est aux alentours de 2000-2200 cycles charge/décharge.
La tension d'une cellule est d'environ 3.2 Volts
La densité énergétique se situe aux alentours de 160 Wh par kg
Résiste jusqu'à un peu plus de 250 degrés
Variante LFPx
Le cycle de vie est aux alentours de 2000-2200 cycles charge/décharge.
La tension d'une cellule est d'environ 3.2 Volts (similaire aux LFP classiques)
La densité énergétique se situe aux alentours de 170 Wh par kg
Résiste jusqu'à un peu plus de 250 degrés
Variante LmFP
Le cycle de vie est aux alentours de 1700-1800cycles charge/décharge.
La tension d'une cellule est d'environ 3.9 Volts
La densité énergétique se situe aux alentours de 190/200 Wh par kg
Résiste jusqu'à un peu plus de 250 degrés
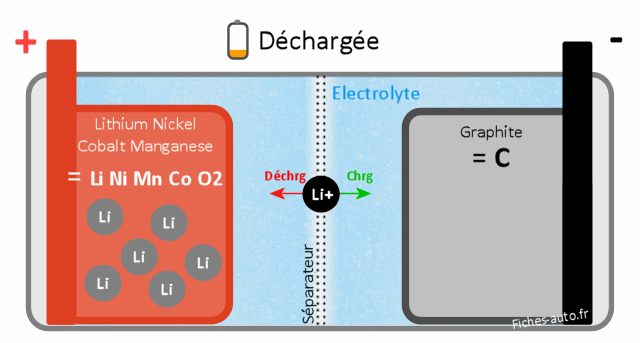
Batterie Lithium Nickel Cobalt Manganèse LiNiMnCoO2 (NMC)
C'est le type de batterie le plus répandu dans le domaine de la voiture électrique, beaucoup de qualités et de compromis.

Toujours exploitant le Lithium-ion comme "moteur" de la batterie chimique, (= atome de Lithium dont on a ôté un électron, il devient donc positif, ce que l'on appelle ionisé. C'est cation pour être très précis, à l'inverse d'un anion) on a côté cathode du Lithium Nickel Cobalt Manganèse, d'où son nom NMC (initiales de ces trois matériaux).
C'est un type de batterie qui accumule plein de compromis, avec aucun gros défaut. Que ce soit au niveau de la densité énergétique, le coût ou encore la durabilité c'est très bon.
Son usage peut être fait pour la voiture électrique.
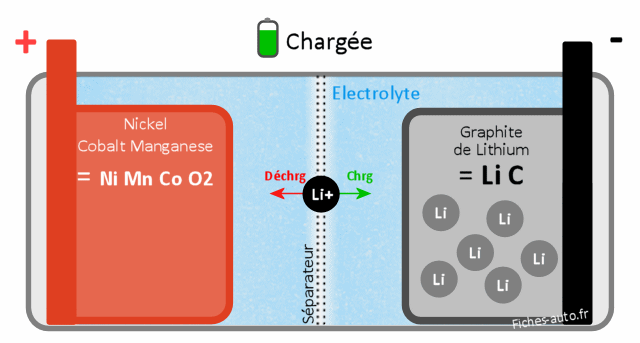
Batterie chargée : du côté cathode c'est du cobalt, du nickel et du manganèse (NiMnCoO2) et côté anode du Lithium de graphite (LiC)
Batterie déchargée : du côté cathode on a du Lithium Nickel Cobalt Manganèse (LiNiMnCoO2) et côté anode du graphite de carbone (C)
Le cycle de vie est aux alentours de 1800-2000 cycles charge/décharge.
La tension d'une cellule est d'environ 3.6 Volts
La densité énergétique se situe aux alentours de 230 Wh par kg
Résiste jusqu'à environ 200 degrés
Batterie Lithium oxyde d'Aluminium Nickel Cobalt LiNiCoAlO2 (NCA)

La batterie Aluminium Nickel Cobalt se révèle assez chère à produire et n'autorise pas des températures de fonctionnement très élevées, il faudra donc lui greffer un système de refroidissement actif.
En revanche on a une densité énergétique est très favorable (rapport encombrement/énergie) et les vitesses de charge sont très bonnes (malgré son in tolérance aux températures élevées dans ses cellules).
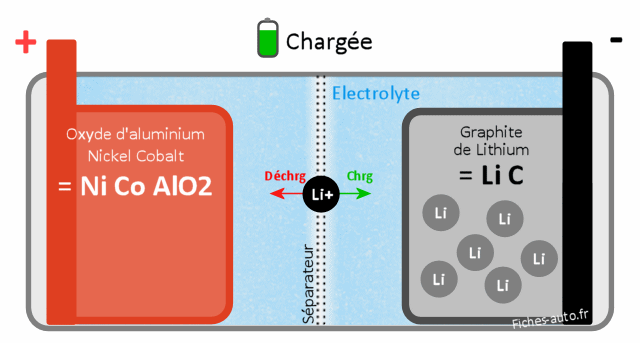
Batterie chargée : côté cathode il y a de l'oxyde d'aluminium Nickel Cobalt (NiCoAlO2) et côté anode du graphite de Lithium (LiC)
Batterie déchargée : côté cathode on a du Lithium d'oxyde d'Aluminium Nickel Cobalt (LiNiCoAlO2) et côté anode du graphite (C)
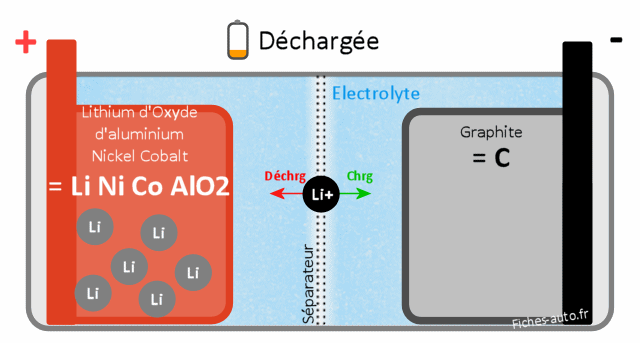
Le cycle de vie est aux alentours de 500 cycles charge/décharge.
La tension d'une cellule est d'environ 3.6 Volts
La densité énergétique se situe aux alentours de 280 Wh par kg
Résiste jusqu'à environ 150 degrés
Batterie Lithium Manganèse LiMn2O4 (MVO)

La cathode est faite de Manganèse et l'anode de graphite (comme presque systématiquement dans les batteries lithium). L'avantage est au niveau de la facilité aux ions lithium de passer d'une électrode à l'autre à travers de la membrane séparatrice, ce qui induit une résistance électrique réduite. L'autre avantage se situe au niveau de sa stabilité thermique, ce qui donne lieu à des recharges rapides mais aussi des décharges qui le sont tout autant (on peut tirer beaucoup d'ampères d'un coup pour obtenir des puissances importantes instantanées).
Le défaut se situe au niveau de la durée de vie assez limitée en terme de cycles recharges/décharges.
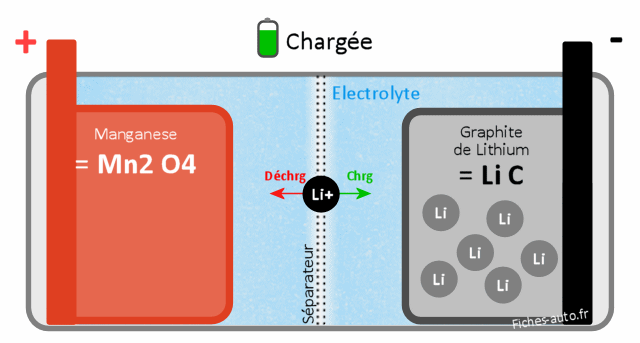
Batterie chargée : côté cathode on a du Manganèse (Mn2O4) et côté anode du graphite de Lithium (LiC)
Batterie déchargée : côté cathode c'est du Lithium de manganèse (LiMn2O4) et côté anode du carbone (sous forme de graphite, comme à chaque fois)
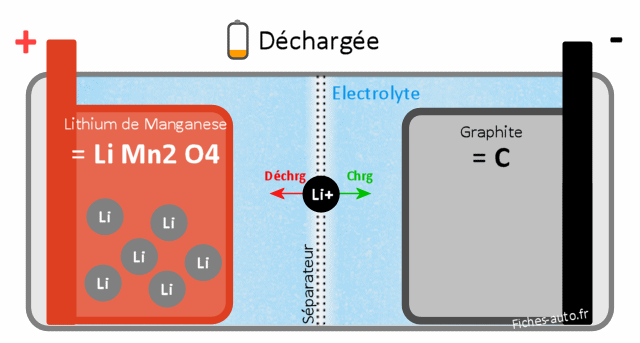
Le cycle de vie est aux alentours de 600 cycles charge/décharge.
La tension d'une cellule est d'environ 3.6 Volts
La densité énergétique se situe aux alentours de 140 Wh par kg
Résiste jusqu'à environ 250 degrés
Avant la technologie lithium : Batterie au Plomb

Une des toutes premières voitures électriques de France, dans les années 70 (photo salon électrique Haute Saintonge 2021)
C'est une technologie totalement obsolète pour la traction des véhicules car la densité énergétique est bien trop faible. Elle a toutefois servi pour les premières autos électriques et je me devais donc d'en parler a minima.

En haut une batterie de servitude au plomb et en bas des packs de batterie lithium-ion
Batterie chargée : du côté de la cathode on a du PbO2 (dioxyde de plomb) et côté anode du du plomb (Pb). L'électrolyte est alors composée d'acide sulfurique 2H2SO4
Batterie déchargée : du côte cathode on a du sulfate de plomb (PbSO4) et du côté anode la même chose : PbSO4. L'électrolyte est alors composée d'eau 2H2O. La batterie est donc équilibrée chimiquement et il n'y a plus de différence de potentiel entre + et - (plus de voltage et finalement disparition des pôles + et -).

Le compartiment moteur
Il ne reste qu'une seule batterie pour la démonstration publique. (Excusez la qualité de la photo mais j'ai eu quelques difficultés à dompter les reflets)
Plus d'informations sur le fonctionnement de la batterie (généralement 12V) au plomb ici.

La densité énergétique est de 40 Wh par kg
Batterie Titanate de Lithium Li4Ti2O12 (LTO)

Ici l'anode n'est pas constituée de graphite comme c'est généralement le cas, ce qui permet d'améliorer la sécurité thermique car il n'y pas ici de risque d'emballement thermique avec risque d'explosion (ce n'est toutefois pas le gros défaut du graphite qui s'avère très efficace dans certains types de batteries et permet de très grosses charges/décharges). Il n'y a pas non plus de formation de couche SEI sur l'anode comme c'est le cas habituellement, ce qui améliore sa durée de vie (cette couche finit par obstruer l'anode et rendre difficile le passage des ions lithium). La charge est 10 fois plus rapides que sur les batteries lithium-ion avec graphite.
On peut donc utiliser d'autres chimies lithium-ion qui fonctionne avec, comme la NMC ou la MVO (à la place du graphite à l'anode de mettez-y du titanate de lithium).
Batterie polymère LMP Lithium Métal Polymère ?
Cela indique tout simplement que l'électrolyte est sous forme de gel, on l'appelle alors batterie solide. Cela permet de rendre la batterie plus sure au niveau des chocs mais sa durée de vie est limitée en terme de cycles, jusqu'à 300 environ ...
L'autre contrainte est un fonctionnement qui nécessite une batterie chaude à au moins 60/80 degrés. Ce type de batterie a été utilisé sur les Autolib, et la contrainte thermique induisait que l'auto devait être branchée au repos pour maintenir les batteries à température.

Graphène ?
Certains ajoutent un peu de graphème sur les anode et cathode afin de gagner encore un peu plus de densité énergétique, comme Tesla par exemple.
Supercondensateur et graphène ?

D'autres accumulateurs vont plus loin avec le graphène, c'est le cas par exemple de la batterie de la Lamborghini Aventador SVJ hybride qui accueille une batterie dite de supercondensateur (en gros la cathode est ici composée d'un alliage entre graphène et MOF [Metal Ornagic Frameworks], un matériaux très poreux constitué d'ions métalliques et des ligands organiques).
L'avantage est la durée de vie associée à des charges/décharges qui peuvent être très rapides (parfait quand on a besoin de beaucoup de puissance d'un coup). Hélas, la densité énergétique est très limitée avec 10 Wh par kg ...
Silicium ?
Il arrive qu'on en ajoute au graphite côté anode mais cela favorise et accentue la dilatation de cette dernière lors de la recharge, et on évite justement qu'il y ait des mouvements dans les cellules, au risque de provoquer un court-circuit (anode qui vient toucher la cathode en transperçant le séparateur).
Batteries du futur ?
La chimie progresse continuellement, ou plutôt l'Homme affine ses connaissances en la matière en découvrant des principes actifs (côté cathode) qui sont de plus en plus performants et adaptés à nos besoins. Car il faut préciser qu'il n'y a pas de batterie idéale, il y a plusieurs chimies qui vont coller avec tel ou tel besoin (certaines privilégient la puissance de charge/décharge, d'autres la longévité, d'autres le poids etc.).
On citera donc quelques technologies à venir comme la batterie au sodium, au lithium-air (LiO2), à électrolyte solide ou encore au lithium souffre.
Ces articles pourraient vous intéresser :
- Durée de vie des batteries lithium-ion de voiture électrique
- Le vieillissement et la dégradation des batteries au lithium
- Les types de cellules lithium-ion
- Batteries LMFP, une variante de la LFP
Ecrire un commentaire
Sondage au hasard :
Que pensez-vous des 50 km/h pour le périphérique parisien ?
Sujets pris au hasard



